Bột kẽm là gì
Các đặc tính của Zinc powder:
Công thức hóa học: Zn
Khối lượng phân tử: 65.39g/mol
Nhiệt độ nóng chảy: 420 °C
Nhiệt độ sôi: 907 °C
Mật độ: 7.14 g/mL ở 25 °C
Áp suất hơi: 1 mm Hg ( 487 °C)
Fp: 1 °F
Nhiệt độ bảo quản: 2-8°C
Tính ổn định: Ổn định, không tương thích với các amin, cadmium, lưu huỳnh, dung môi clo, axit mạnh, bazơ mạnh. Nhạy cảm với không khí và độ ẩm. Bột kẽm rất dễ cháy.
Bột kẽm là loại bột màu xám, không hòa tan trong nước. Có thể sản sinh ra khói kẽm oxit độc khi đun nóng đến nhiệt độ rất cao hoặc khi bị đốt cháy.
Ứng dụng của bột kẽm Zn:
Bột kẽm được sử dụng trong sản xuất sơn, trong công nghiệp cao su, chất tẩy trắng và dùng điều chế các chất khác.
Bài tập ôn tập bột kẽm
Bài 1: Dung dịch nào được dùng để làm sạch bột đồng có lẫn bột sắt?
A. Dung dịch HCl
B. Dung dịch Ca(OH)2
C. Dung dịch NaOH
D. Dung dịch FeSO4
Lời giải:
Bột đồng không phản ứng với dung dịch HCl vì vậy khi cho hỗn hợp này vào dung dịch HCl dư, Sắt tan hoàn toàn theo phương trình:
Fe + HCl → FeCl2 + H2
Lọc kết tủa, ta thu được đồng.
Bài 2: Cho 2,6 gam bột kẽm vào 100 ml dung dịch CuCl2 0,75M. Lắc kĩ cho đến khi phản ứng kết thúc. Xác định số mol của các chất trong dung dịch thu được.
lời giải:
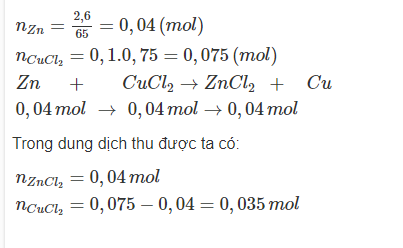
Bài 3: Đốt cháy hoàn toàn 26g bột kẽm trong không khí
a. Viết phương trình hóa học phản ứng xảy ra .
b. Hãy tính thể tích khí oxi và thể tích không khí cần dùng ( ở đktc ).Biết rằng khí oxi chiếm 20%thể tích không khí .
c. Khi cho 26g bột kẽm phản ứng với dung dịch chứa 21,9 gam axit clohiđric HCl. Hãy cho biết chất nào dư và sau phản ứng sẽ thu được bao nhiêu gam muối kẽm clorua.
Lời giải:
a) PTHH: 2Zn + O2 —> 2ZnO ( có t° )
2 1 2
0,4 0,2 0,4 ( mol )
Ta có: nZn = m/M = 26/65= 0,4(mol)
b) Theo PTHH và đề bài, ta có:
nO2 = 0,2 (mol)
=> VO2 ( đktc ) = 0,2.22,4=4,48(l)
=> VKK ( đktc ) = 4,48.5= 22,4 ( l )
Bài 4: Cho 19,3 gam hỗn hợp bột gồm Zn và Cu có tỉ lệ mol tương ứng là 1 : 2 vào dung dịch chứa 0,2 mol Fe2(SO4)3. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam kim loại. Giá trị của m là:
| A. | 6,40 |
| B. | 16,53 |
| C. | 12,00 |
| D. | 12,80 |
lời giải:
Gọi x là số mol của Zn thì số mol của Cu là 2x: 65x + 64.2x = 19,3.
x = 0,1. nZn=0,1; nCu=0,2; nFe =0,4. Vì số mol Fe3+ lớn hơn số mol của Cu và Zn nên để đơn giản ta làm như sau:
Các PƯ: Zn + 2Fe3+ → 2Fe2+ + Zn2+
0,1. . . 0,2
Cu + 2Fe3+ → 2Fe2+ + Cu2+
0,2 0,2
Nên số mol Cu dư là 0,1. m=6,40
Tag: g 100ml bán bé đâu mua 6g 5 5g cả hno3 loãng dạng ngâm một nung 13 nhập khẩu nhật thủ tục phosphate stearate
 Công Ty Hóa Chất Hanimex HANIMEX Chemical
Công Ty Hóa Chất Hanimex HANIMEX Chemical