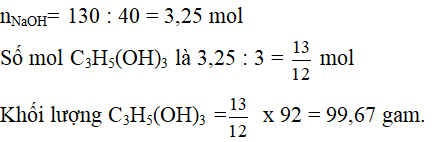Bộ Đề Thi – Lời Giải Bài Tập Hóa Học Lớp 9
Câu 1: (2 điểm) Giấy quỳ tím chuyển màu gì khi nhúng vào dung dịch được tạo thành từ
a) 0,5 mol H2SO4 và 1 mol NaOH
b) 2 mol HCl và 1 mol KOH?
Câu 2: (1 điểm) Phản ứng: BaCl2 + Na2SO4 → BaSO4 + 2NaCl được gọi là phản ứng gì?
Câu 3: (2 điểm) Vì sao K2O tan được trong nước?
Câu 4: (2 điểm) Đốt hỗn hợp bột S và Zn trong bình kín theo tỉ lệ 1 : 2 về khối lượng. Sau khi phản ứng xảy ra hoàn toàn thu được chất rắn X.
Xác định thành phẩn của chất rắn X (Zn = 65, S=32).
Tính khối lượng hỗn hợp muối sunfat khan thu được (H=1, S=32, O=16).
Đáp án và hướng dẫn giải
Câu 1:
a) H2SO4 + 2NaOH → Na2SO4 + 2H2O
nNaOH = 2nH2SO4 đúng theo phương trình. Sau phản ứng chỉ có Na2SO4, nên môi trường trung tính không làm đổi màu quỳ tím.
HCl + KOH → KCl + H2O
nHCl > nKOH : HCl dư, quỳ tím chuyển màu đỏ.
Câu 2:
Phản ứng trao đổi, do thành phần phân tử các chất không đổi.
Câu 3:
K2O + H2O → 2KOH.
KOH tan mạnh trong nước, nên K2O tan được trong nước.
Câu 4:
S + Zn → ZnS
nS : nZn = 1/32 : 2/65
Với tỉ lệ đó so với tỉ lệ mol của phương trình thì sau phản ứng S dư.
Nên sản phẩm là ZnS và S.
Câu 5:
Gọi M chung cho cả 2 kim loại: M + H2SO4 → MSO4 + H2
Nhận xét: nSO4 luôn luôn = nH2 = 0,015 mol
=> mMSO4 = mM + mSO4 = 1,52 + 96 x 0,015 = 2,96 gam.
Câu 1: (1,5 điểm) Viết 3 phương trình phản ứng điều chế glucozo.
Câu 2: (1,5 điểm) Để xác minh đường gluocozo (thường có trong nước tiểu của người bệnh đái đường) người ta chọn thuốc thử nào? Viết phương trình hóa học để minh họa.
Câu 3: (2 điểm) Khi đốt cháy cùng số mol các khí: CH4, C2H4, C3H4, C4H4. Tính tỉ lệ theo thể tích của khí oxi cần dùng để đốt cháy mỗi chất (đo cùng điều kiện).
Câu 4: (2,5 điểm) Xà phòng hóa hoàn toàn 964,2g một loại chất béo thuộc dạng (RCOO)3C3H5, cần vừa đủa 130g NaOH. Tính khối lượng muối của axit hữu cơ thu được (cho H=1, C=12, O=16, Na=23).
Câu 5: (2,5 điểm) Nhúng một thanh sắt vào dung dịch CuSO4 sau một thời gian lấy thanh sắt ra khổi dung dịch cân lại thấy nặng thêm 0,8g. Khối lượng dung dịch giảm so với ban đầu là bao nhiêu gam (Cu=64, Fe=56)?
Đáp án và hướng dẫn giải
Câu 1:
Từ saccarozo: C12H22O11 + H2O H2SO4→ 2C6H12O6
Từ tinh bột: (C6H10O5)n + nH2O H2SO4→ nC6H12O6
Từ xenlulozo: (C6H10O5)n + nH2O H2SO4→ nC6H12O6
Câu 2:
Dung dịch AgNO3 trong NH3
Ag2O + C6H12O6 NH3→ C6H12O7 + 2Ag
Câu 3:
CH4 + 2O2 to→ CO2 + 2H2O
C2H4 + 3O2 to→ 2CO2 + 2H2O
C3H4 + 4O2 to→ 3CO2 + 2H2O
C4H4 + 5O2 to→ 4CO2 + 2H2O
Tỉ lệ thể tích oxi cần dùng lần lượt: 2:3:4:5.
Câu 4:
(RCOO)3C3H5 + 3NaOH to→ C3H5(OH)3 + 3RCOONa
Dùng định luật bảo toàn khối lượng:
Khối lượng chất béo + khối lượng NaOH = Khối lượng C3H5(OH)3 + khối lượng muối của axit hữu cơ.
=> Khối lượng muối = 964,2 + 130 – 99,67 = 994,5 gam.
Câu 5:
Fe + CuSO4 → Cu + FeSO4
Theo phương trình cứ 56 gam Fe tan vào dung dịch thì có 64 gam Cu tách ra khỏi dung dịch. Thanh Fe tăng khối lượng nên khối lượng dung dịch phải giảm đi đúng bằng khối lượng thanh Fe tăng lên.
Vậy khối lượng thanh sắt tăng 0,8 gam → khối lượng dung dịch giảm so với ban đầu 0,8 gam.
PHÒNG GIÁO DỤC VÀ ĐÀO TẠO
HUYỆN TRỰC NINH
ĐỀ CHÍNH THỨC
(Đề thi gồm 01 trang)
ĐỀ THI CHỌN HỌC SINH GIỎI
NĂM HỌC 2014-2015
MÔN HÓA HỌC LỚP 9
(Thời gian làm bài 120 phút, không kể thời gian giao đề)
Câu 1. (4,5đ)
1.Cho mỗi chất P2O5, Fe3O4, NaOH, NaNO3 vào dung dịch H2SO4 loãng. Viết các phương trình hoá học xảy ra nếu có.
2. Nêu hiện tượng, và viết phương trình hóa học cho các thí nghiệm sau:
a. Dẫn từ từ khí CO2 đến dư vào dung dịch nước vôi trong.
b. Cho dây sắt(đã nung nóng đỏ) vào bình đựng khí clo.
3. Viết phương trình phản ứng khi cho HCl tác dụng với 4 chất khác nhau sinh ra 4 chất khí khác nhau
Câu 2. (2,5đ)
Hòa tan một kim loại chưa biết hóa trị trong dung dịch HCl thì thấy thoát ra 11,2 lít H2 (đktc). Trung hòa axit dư bằng 100ml dung dịch Ca(OH)2 1M sau đó cô cạn dung dịch thu được thì thấy còn lại 55,6 gam muối khan. Xác định tên của kim loại đã dùng.
Câu 3. (2,5đ) Viết phương trình hoá học thực hiện dãy chuyển đổi hoá học sau (ghi rõ điều kiện phản ứng, nếu có)
M oxit axit (1) oxit axit(2) axit muối axitmuối trung hoà
Với M là thành phần chính của một loại quặng
Câu 4. (2,5đ) Để m gam bột sắt ngoài không khí một thời gian thu được chất rắn X( gồm 4 chất) có khối lượng (m + 2,4) gam. Nếu cho toàn bộ X tác dụng với lượng dư dung dịch H2SO4 đặc, nóng thu được 6,72 lít SO2(đktc)
a.Viết phương trình phản ứng xảy ra.
b.Tính số mol H2SO4 tham gia phản ứng.
Câu 5 (2,5đ)
1. Có 4 dung dịch không màu bị mất nhãn: K2SO4; K2CO3; HCl; BaCl2. Nêu cách nhận ra từng dung dịch mà chỉ dùng thêm một kim loại. Viết phương trình hoá học.
2. Có bột sắt lẫn tạp chất nhôm. Bằng phương pháp hóa học hãy làm sạch sắt?
Câu 6 (3,5đ). Cho 27,4g Ba vào 400 gam dung dịch CuSO4 3,2% thu được khí A, kết tủa B và dung dịch C.
Tính thể tích khí A(đktc).
Nung kết tủa B ở nhiệt độ cao đến khối lượng không đổi thu được bao nhiêu gam chất rắn.
Tính nồng độ % của các chất trong dung dịch C.
Câu 7 (2,0đ). Cho 3,36 lít CO(đktc) đi qua ống sứ đựng 8 gam CuO nung nóng. Sau khi kết thúc thí nghiệm, cho khí hấp thụ hoàn toàn vào dung dịch Ba(OH)2 dư, thấy tạo ra 14,775 gam kết tủa. Tính hiệu suất của phản ứng khử CuO.
(Học sinh được sử dụng bảng tuần hoàn các nguyên tố hóa học và bảng tính tan)
-------------------HẾT--------------------
Họ và tên thí sinh: Họ, tên chữ ký GT1:..
Só báo danh: Họ, tên chữ ký GT2:..
HƯỚNG DẪN CHẤM THI CHỌN HỌC SINH GIỎI
NĂM HỌC 2014-2015 * MÔN HÓA HỌC LỚP 9
Câu
Đáp án
Điểm
1
4,5đ
3H2O + P2O5 2H3PO4
Fe3O4 + 4 H2 SO4 FeSO4 + Fe2(SO4)3 + 4H2O
2NaOH + H2SO4 Na2SO4 + 2H2O
NaNO3 + H2SO4 không xảy ra
2 Xuất hiện kết tủa ngày một nhiều, sau đó kết tủa tan dần tạo dung dịch trong suốt đồng nhất.
CO2 + Ca(OH)2 → CaCO3 + H2O
CO2 + CaCO3 + H2O → Ca(HCO3)2
b. Sắt cháy sáng tạo thành khói màu nâu đỏ
2Fe + 3Cl2 2FeCl3
3. - Điều chế khí CO2 :Na2CO3 + 2HCl → 2NaCl + H2O + CO2 ↑
- Điều chế khí H2 :Fe + 2HCl → FeCl2 + H2 ↑
- Điều chế khí H2S :FeS + 2HCl → FeCl2 + H2S↑
- Điều chế khí SO2 :Na2SO3 (rắn) + 2HCl → Na2SO4 + H2O + SO2
0,25
0,25
0,25
0,25
0,5
0,5
0,25
0,25
0,5
0,5
0,5
0,5
2
2,5đ
Giả sử kim loại là R có hóa trị là x Þ 1£ x, nguyên £ 3
số mol Ca(OH)2 = 0,1´ 1 = 0,1 mol
số mol H2 = 11,2 : 22,4 = 0,5 mol
Các PTPƯ:
2R + 2xHCl ® 2RClx + xH2 (1)
Ca(OH)2 + 2HCl ® CaCl2 + 2H2O (2)
0,1 0,2 0,1
từ các phương trình phản ứng (1) và (2) suy ra:
Số mol RClx = 2/x . số mol H2 = 1/x
Số mol CaCl2 = số mol Ca(OH)2 = 0,1 mol
theo các PTPƯ ta có :
ta có : ×( R + 35,5x ) = 44,5 Þ R = 9x
x
1 2 3
R
9 18 27
Vậy kim loại thoã mãn đầu bài là nhôm Al ( 27, hóa trị III )
1,0
0,5
1,0
3
2,5đ
M là FeS2
4 FeS2 + 11O2 2Fe2O3 + 8SO2
2SO2 + O2 2SO3
SO3 + H2O H2SO4
H2SO4 + NaOH NaHSO4 + H2O
NaHSO4 + NaOH Na2SO4 + H2O
0,25
0,5
0,5
0,25
0,5
0,5
4
2,5đ
2Fe + O2 -> 2FeO
3Fe + 2O2 -> Fe3O4
4Fe + 3O2 -> 2Fe2O3
4 chất rắn là FeO, Fe3O4, Fe2O3, Fe
2FeO + 4H2SO4 Fe2(SO4)3 + SO2 + 4H2O (1)
2Fe3O4 + 10H2SO4 3Fe2(SO4)3 + SO2 + 10H2O (2)
2Fe + 6H2SO4 Fe2(SO4)3 + 3SO2 + 6H2O (3)
Fe2O3 + 3H2SO4 Fe2(SO4)3 + 3H2O (4)
Theo ĐLBTKL ta có: s ố mol O trong X = 2,4/16 = 0,15 mol
số mol SO2 = 6,72/22,4 = 0,3 mol
Đặt số mol Fe = a, FeO = b, Fe3O4 = c, Fe2O3 = d
Số mol O = b + 4c+3d = 0,15
Theo PTHH ( 1,2,3) ta có: 3/2 a+1/2b+1/2c = 0,3=> 3a+b+c =0,6
Số mol H2SO4 = 3a+ 2b+5c+3d = (b+4c+3d) +(3a+b+c) = 0,15+ 0,6 = 0,75 mol
0,5
1,0
1,0
5
2,5đ
Trích mỗi chất một ít đánh dấu đem thử
Cho Mg vào các mẫu thử trên. Sủi bọt khí là dd HCl, không có hiện tượng gì là dd K2So4, K2CO3, BaCl2 (nhóm 1)
Cho dd HCl vừa nhận được ở trên vào các mẫu thử ở nhóm 1.
Nếu sủi bọt khí là K2CO3, không có hiện tượng gì là BaCl2 và K2SO4( nhóm 2)
2HCl + K2CO3 -> 2KCl + CO2 + H2O
Cho dd K2Co3 vừa nhận được ở trên vào dd ở nhóm 2. Nếu xuất hiện kết tủa là dd BaCl2, không có hiện tượng gì là dd K2So4
BaCl2 + K2CO3 -> BaCo3 + 2KCl
2. Cho Bột sắt có lẫn tạp chất nhôm vào dd NaOH dư. Al tan, Fe không tan. Lọc ta thu được Fe
2Al + 2NaOH + 2H2O -> 2Na AlO2 + 3H2
0,5
0,5
0,75
0,5
0,25
6
3,5đ
Số mol Ba = 27,4/137 = 0,2 mol, Số mol CuSO4 = 400.3,2/100 = 12,8 gam
Số mol CuSO4 = 12,8/160 = 0,08 mol
Ba + 2H2O Ba(OH)2 + H2 (1)
Theo (1) Sô mol Ba(OH)2 = số mol H2 = số mol Ba = 0,2 mol
Thể tích H2 = 22,4 .0,2 = 4,48 lít
b.
Ba(OH)2 + CuSO4 Cu(OH)2 + BaSO4 (2)
Ta có số mol Ba(OH)2 > số mol CuSO4 => Ba(OH)2 dư
chất rắn B gồm Cu(OH)2 và BaSO4, dung dịch C là dd Ba(OH)2 dư.
Theo (2) Số mol Ba(OH)2pư = Số mol CuSO4 = số mol Cu(OH)2 = Số mol BaSO4 = 0,08 mol
Cu(OH)2 CuO + H2O (3)
Theo(3) số mol CuO = số mol Cu(OH)2 = 0,08 mol
Khối lượng chất rắn thu được là: 0,08.80 + 0,08.233 = 25,04 g
c.
Khối lượng dung dịch C = 27,4+400- 0,2 . 2 – 0,08.98-0,08.233 = 400, 52g
Số mol Ba(OH)2 dư = 0,2 – 0,08 = 0,12 mol
C% Ba(OH)2 dư = 0,12.171. 100%/400,52 = 5,12%
1,0
0,5
1,0
1,0
7
Số mol CO = 3,36/22.4 = 0,15 mol Số mol CuO = 8/80 = 0,1 mol
CO + CuO Cu + CO2 (1)
CO2 + Ba(OH)2 BaCO3 + H2O (2)
Số mol BaCO3 = 14,775/197 = 0,075 mol
Theo (2) số mol CO2 = số mol BaCO3 = 0,075 mol
Giải sử H = 100% ta thấy số mol CO> số mol CuO => CuO hết, CO dư
Vậy ta tính H theo CuO
Theo (1) số mol CuO phản ứng = số mol CO2 = 0,075 mol
H = 0,075/0,1 . 100% = 75%
0,5
0,5
1,0
( Chú ý: Học sinh có thể giải các bài tập theo cách khác, nếu đúng vẫn cho điểm tối đa.
Phương trình hoá học viết đúng nhưng chưa cân bằng được nửa số điểm của phương trình ấy)
tag thpt quốc 2019 soạn sgk thông tư 39 đơn bt kiểm tra tiết chương hoạt dộng sbt hsg cấp 2017-2018 sách 39/2015/tt-btc công violet kì phối trang phát hành ôn 19 cương triển năng lực khoa hay vở hk2 dap an mới phố chuyên 39/2014/tt-btc chủ tỉnh tốt hỏi tế luyện chuỗi 38 tổng lý thuyết đại gtgt kiến nhớ 119 quan trọng thai canxi 31 26 10 33 nghị 89 nhãn hàng 18 30 29 34 chi mua bán 42 41 tóm tắt 40 hk1 game lậu việt bón trắc vô benzen 46 phụ lục cáo tình hình nhà tuổi 1983 109 loigiaihay thích 16 39/2014 bồi dưỡng 2018-2019 43 295 32 online 59 cổ nâng 37 liên virus mã dữ liệu đòi tiền chuộc 17 quy pes phi 143 28 dynasty warriors pvc polime chứa 63 sơ đồ duy tt39 file word nguyền rượu etylic hoc chinh phục 458 axetilen pdf khảo dđề chữa kemulator sánh lối nghiệp trước (1986) toán 20 69 vietjack những giảng hiểm icc 1982 bản web oxygen not included 139 nhiên ma trận 2017 112 ghi 23 tường cấu trúc 95 60 giai 2015 cây bút bi biện nghệ thuật nhân hà nội 1981 47 de 13 dầu mỏ thiên 21 hệ chuẩn kĩ 49 144 bước este xã hội 45 axetic điện 24 59/2011/nđ-cp đố vui gang thép 91
 Công Ty Hóa Chất Hanimex HANIMEX Chemical
Công Ty Hóa Chất Hanimex HANIMEX Chemical