Axit là gì – Khái niệm axit
Axit là những hợp chất có một hay nhiều nguyên tử hidro liên kết với gốc axit.
– Axit mạnh:
+ HCl: Axit clohidric
+ H2SO4: Axit sunfuric
+ HNO3: Axit nitric
– Axit yếu:
+ H2S: Axit sunfuhidric
+ H2CO3: axit cacbonic
5 tính chất hóa học của axit
+ Làm đổi màu quì tím
+ Tác dụng với kim loại
+ Tác dụng với bazơ
+ Tác dụng với oxit bazơ
+ Tác dụng với muối
Cách xác định độ mạnh, yếu của axit
– Dựa vào sự linh động của nguyên tử Hydro trong axit đó. Nếu H càng linh động, tính axit càng mạnh và ngược lại.
– Với những axit có oxy trong cùng một nguyên tố, càng ít oxy, axit càng yếu
HClO4 > HClO3> HClO2> HClO
– Với những axit của nguyên tố trong cùng chu kỳ, khi các nguyên tố ở hóa trị cao nhất, nguyên tố trung tâm có tính phi kim càng yếu thì axit đó càng yếu.
HClO4> H2SO4> H3PO4
– Với axit của nguyên tố cùng nhóm A
+ Axit có oxy: Tính axit tăng dần từ dưới lên: HIO4 < HbrO4< HClO4
+ Axit không có oxy: Tính axit giảm dần từ dưới lên: HI > HBr> HCl> HF
– Với axit hữu cơ RCOOH
+ Nếu R đẩy electron (gốc R no) thì tính axit giảm
HCOOH> CH3COOH> CH3CH2COOH> CH3CH2CH2COOH> n-C4H9COOH.
+ Nếu R hút e (gốc R không no, thơm hoặc có nguyên tố halogen,…), tính axit sẽ mạnh
PHÂN LOẠI AXIT VÀ CÁCH ĐỌC TÊN AXIT
Phân loại axit như thế nào?
Axit được chia thành những loại nào và dựa vào những tiêu chí nào để có thể phân loại như vậy. Sau đây chúng ta sẽ cùng tìm hiểu.
Dựa vào tính chất hóa học, ta có thể chia thành:
Axit mạnh : Khi hòa tan vào axit này tạo thành dung dịch có độ pH nhỏ hơn 7 rất nhiều. Độ pH càng nhỏ thì tính axit càng mạnh.
Ví dụ: HCL, HNO3, H2SO4, …
Axit yếu : Đây là axit khi hòa tan vào nước sẽ tạo thành dung dịch có độ pH gần 7 hơn so với axit ở trên
Ví dụ: H2S. H2CO3, …
Dựa vào nguyên tử Oxi, ta có thể axit thành.
Axit không có oxi ví dụ như HCl, H2S, HBr, HI, HF…
Axit có oxi: H2SO4, HNO3, H3PO4, H2CO3…
Ngoài ra, ta còn có thể phân chia axit theo như các dạng dưới đây:
Axit vô cơ và hữu cơ như HCL, H2SO4,CH3COOH
Các kim loại ở dạng hidrat hóa như Al(H2O)3 3+, Cu(H20)2 2+, ….
Các ion như H+, H3O+, NH4+, …
Cách đọc tên axit như thế nào?
Axit không có oxi
Tên axit = axit + tên latinh của phi kim + hiđric
Ví dụ:
HCl : axit clohiđric với là clorua
H2S : axit sunfuhiđric với S sunfua
Axit có nhiều oxi
Tên axit = axit + tên latinh của phi kim + ic
Ví dụ:
HNO3 : axit nitric với NO3 là nitrat
H2SO4 : axit sunfuric với SO4 là sunfat
H3PO4 : axit photphoric với PO4 là photphat
Axit có ít nguyên tử oxi
Tên axit = axit + tên latinh của phi kim + ơ
Ví dụ:
HNO2 : axit nitrơ với NO2 là nitrit
H2SO3 : axit sunfurơ với SO3 là sunfit.
Tính chất vật lý của axit:
– Tan trong nước, có vị chua
– Khi tiếp xúc với axit mạnh, có cảm giác đau nhói
– Là chất điện li nên có thể dẫn điện
Tính chất hóa học của axit:
1. Axit làm đổi màu giấy quì tím:
– Ở điều kiện bình thường, giấy quỳ tím là giấy có màu tím, tuy nhiên màu của nó thay đổi khi cho vào các môi trường (axit, bazơ) khác nhau. Trong môi trường axit giấy quỳ tím chuyển sang màu đỏ, trong môi trường kiềm giấy quỳ tím chuyển sang màu xanh.
– Do đó dung dịch axit làm đổi màu giấy quỳ tím thành đỏ
– Dựa vào tính chất này, giấy quì tím được dùng để nhận biết dung dịch axit.
2. Axit tác dụng với kim loại:
– Nguyên tắc: Axit + kim loại -> muối + H2
– Điều kiện phản ứng:
Axit: thường dùng là HCl, H2SO4 loãng (nếu là H2SO4 đặc thì không giải phóng H2)
Kim loại: Đứng trước H trong dãy hoạt động hóa học của kim loại
Dãy hoạt động hóa học của kim loại:
K … Na …..Ca ….Mg ….Al …Zn … Fe … Ni… Sn … Pb … H … Cu … Hg… Ag… Pt…. Au
Khi … nào ..cần…may… áo… Záp …sắt. ..nên…sang… phố … hỏi.. cửa …hàng… á.. phi…. âu
– Ví dụ:
2Na + 2HCl → 2NaCl + H2
Mg + H2SO4(loãng) → MgSO4 + H2
Fe + 2HCl → FeCl2 + H2
– Chú ý: Sắt khi tác dụng với HCl, H2SO4 loãng tạo muối sắt (II) chứ không tạo muối sắt (III)
3. Tác dụng với bazơ:
– Nguyên tắc: Axit + Bazơ -> muối + Nước
– Điều kiện: Tất cả các axit đều tác dụng với bazơ. Phản ứng xảy ra mãnh liệt và được gọi là phản ứng trung hòa
– Ví dụ:
NaOH + HCl → NaCl + H2O
Mg(OH)2 + 2HCl → MgCl2+ 2H2O
4. Tác dụng với oxit bazơ:
– Nguyên tắc: Axit + oxit bazơ -> muối + Nước
– Điều liện: Tất cả các axit đều tác dụng với oxit bazơ.
– Ví dụ:
Na2O + 2HCl → 2NaCl + H2
FeO + H2SO4(loãng) → FeSO4 + H2O
CuO + 2HCl → CuCl2 + H2O
5. Tác dụng với muối:
– Nguyên tắc: Muối (tan) + Axit (mạnh) → Muối mới (tan hoặc không tan) + Axit mới (yếu hoặc dễ bay hơi hoặc mạnh).
– Điều kiện:
Muối tham gia tan, Axit mạnh, muối tạo thành không tan trong axit sinh ra
Chất tạo thành có ít nhất 1 kết tủa hoặc một khí bay hơi
Sau phản ứng, nếu muối mới là muối tan thì axit mới phải yếu, nếu muối mới là muối không tan thì axit mới phải là axit mạnh
– Ví dụ:
H2SO4 + BaCl2 → BaSO4(r) + 2HCl
K2CO3 + 2HCl → 2KCl + H2O + CO2 (H2CO3 phân hủy ra H2O và CO2)
Một số ứng dụng của axit trong cuộc sống
– Loại bỏ gỉ sắt cũng như những sự ăn mòn khác từ kim loại
– Axit sulfuric được dùng làm chất điện phân trong pin xe hơi
– Axit mạnh được dùng nhiều trong công nghiệp chế biến khoáng sản
– Trong khai thác dầu, Axit clohydric được sử dụng để bơm vào trong tầng đá của giếng dầu nhằm hòa tan một phần đá hay còn gọi là “rửa giếng”, từ đó tạo ra các lỗ rỗng lớn hơn
– Hòa tan vàng và bạch kim bằng cách trộn lẫn HCl và HNO3 đặc với tỷ lệ 3:1
– Dùng làm chất phụ gia trong chế biến và bảo quản đồ uống, thực phẩm
– Axit nitric tác dụng với ammoniac để tạo ra phân bón amoni nitrat, một phân bón.
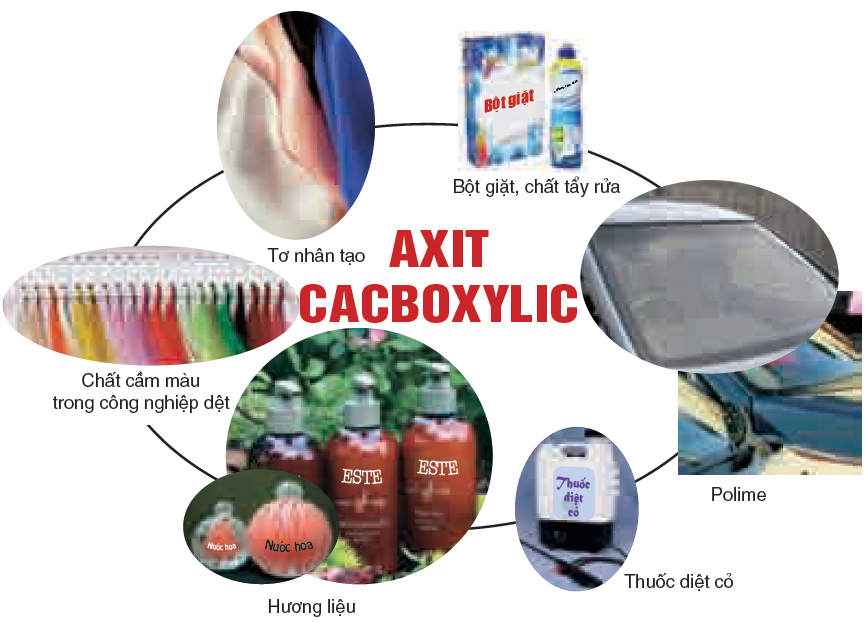
– Axit cacboxylic có thể được este hóa với rượu cồn, để tạo ra este.
– Trong y học
+ Axit acetylsalicylic (Aspirin) được sử dụng như một thuốc giảm đau và làm giảm cơn sốt
+ Axit boric dùng làm chất khử trùng các vết bỏng hoặc vết cắt nhỏ. Khi pha loãng sẽ được dung dịch rửa mắt. Đồng thời, nó cũng là chất chống vi khuẩn được sử dụng để điều trị bệnh mụn trứng cá, bệnh phồng chân ở vận động viên và làm chất bảo quản chai mẫu nước tiểu trong các thí nghiệm.
– Axit clohydric có trong dạ dày giúp cơ thể tiêu hóa thức ăn
– Amino axit được dùng để tổng hợp các protein cần thiết cho sự phát triển của sinh vật và sửa chữa các mô cơ thể.
– Các axit nucleic rất cần thiết cho việc sản xuất ADN, ARN và chuyển các đặc tính sang con lai qua gen.
– Axit cacbonic cần thiết để duy trì sự cân bằng độ pH trong cơ thể
MỘT SỐ AXIT PHỔ BIẾN QUAN TRỌNG NHẤT
AXIT CLOHIĐRIC (HCl)
HCl là một axit mạnh, có đầy đủ tính chất của một axit mạnh. Dung dịch HCl đậm đặc là dung dịch bão hòa hiđroclorua, có nồng độ khoảng 37%, từ đây ta có thể pha chế thành dung dịch HCl có nồng độ khác nhau.
HCl có những ứng dụng như Điều chế các muối clorua, Làm sạch bề mặt kim loại trước khi hàn, Tẩy gỉ kim loại trước khi sơn, tráng, mạ kim loại, Dùng trong chế biến thực phẩm, dược phẩm.
AXIT SUNFURIC (H2SO4)
Axit H2SO4 là chất lỏng sánh, không màu, nặng gấp hai lần nước, không bay hơi, tan dễ dàng trong nước và tỏa nhiều nhiệt. Ngoài ra chúng ta còn có thể nhìn thấy H2SO4 dưới dạng đậm đặc.
Axit H2SO4 loãng và H2SO4 đặc có những tính chất hóa học khác nhau. tuy nhiên về cơ bản nó cũng mang những tính chất của một axit mạnh.
Ứng dụng của H2SO4 rất hữu dụng như là nguyên liệu của nhiều ngành sản xuất hóa học như sản xuất phân bón, phẩm nhuộm, chế biến dầu mỏ,..
…
Tag: wiki tiếng việt j la gi nghĩa mua đâu
 Công Ty Hóa Chất Hanimex HANIMEX Chemical
Công Ty Hóa Chất Hanimex HANIMEX Chemical