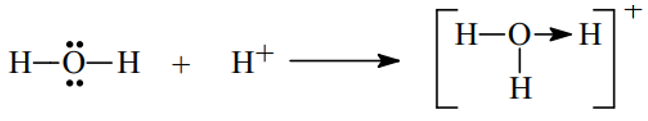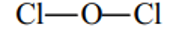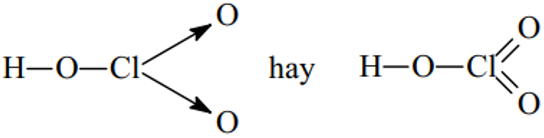Hợp chất là gì
Có mấy loại hợp chất vô cơ
Có 4 loại hợp chất vô cơ: oxit, axit, bazo, muối.
+) oxit : CuO: đồng(II) oxit; Fe2O3: Sắt(III) oxit
+) axit: HCl: axit clohidric; H2S: axit sufuhidric
+) bazo: NaO: natri hidroxit; Fe(OH)3: sắt(III) hidroxit
+) muối: ZnCl2: kẽm clorua; KHCO3: kali hidrocacbonat
| OXIT | AXIT | BAZƠ | MUỐI | |
| ĐỊNH NGHĨA | Là hợp chất của oxi với 1 nguyên tố khác | Là hợp chất mà phân tử gồm 1 hay nhiều nguyên tử H liên kết với gốc axit | Là hợp chất mà phân tử gồm 1 nguyên tử kim loại liên kết với 1 hay nhiều nhóm OH | Là hợp chất mà phân tử gồm kim loại liên kết với gốc axit. |
| CTHH | Gọi nguyên tố trong oxit là A hoá trị n. CTHH là:
– A2On nếu n lẻ – AOn/2 nếu n chẵn |
Gọi gốc axit là B có hoá trị n.
CTHH là: HnB |
Gọi kim loại là M có hoá trị n
CTHH là: M(OH)n |
Gọi kim loại là M, gốc axit là B
CTHH là: MxBy |
| TÊN GỌI | Tên oxit = Tên nguyên tố + oxit
Lưu ý: Kèm theo hoá trị của kim loại khi kim loại có nhiều hoá trị. Khi phi kim có nhiều hoá trị thì kèm tiếp đầu ngữ. |
– Axit không có oxi: Axit + tên phi kim + hidric
– Axit có ít oxi: Axit + tên phi kim + ơ (rơ) – Axit có nhiều oxi: Axit + tên phi kim + ic (ric) |
Tên bazơ = Tên kim loại + hidroxit
Lưu ý: Kèm theo hoá trị của kim loại khi kim loại có nhiều hoá trị. |
Tên muối = tên kim loại + tên gốc axit
Lưu ý: Kèm theo hoá trị của kim loại khi kim loại có nhiều hoá trị. |
| TCHH | 1. Tác dụng với nước
– Oxit axit tác dụng với nước tạo thành dd Axit – Oxit bazơ tác dụng với nước tạo thành dd Bazơ 2. Oxax + dd Bazơ tạo thành muối và nước 3. Oxbz + dd Axit tạo thành muối và nước 4. Oxax + Oxbz tạo thành muối |
1. Làm quỳ tím ® đỏ hồng
2. Tác dụng với Bazơ ® Muối và nước 3. Tác dụng với oxit bazơ ® muối và nước 4. Tác dụng với kim loại ® muối và Hidro 5. Tác dụng với muối ® muối mới và axit mới |
1. Tác dụng với axit ® muối và nước
2. dd Kiềm làm đổi màu chất chỉ thị – Làm quỳ tím ® xanh – Làm dd phenolphtalein không màu ® hồng 3. dd Kiềm tác dụng với oxax ® muối và nước 4. dd Kiềm + dd muối ® Muối + Bazơ 5. Bazơ không tan bị nhiệt phân ® oxit + nước |
1. Tác dụng với axit ® muối mới + axit mới
2. dd muối + dd Kiềm ® muối mới + bazơ mới 3. dd muối + Kim loại ® Muối mới + kim loại mới 4. dd muối + dd muối ® 2 muối mới 5. Một số muối bị nhiệt phân |
| Lưu ý | – Oxit lưỡng tính có thể tác dụng với cả dd axit và dd kiềm | – HNO3, H2SO4 đặc có các tính chất riêng | – Bazơ lưỡng tính có thể tác dụng với cả dd axit và dd kiềm | – Muối axit có thể phản ứng như 1 axit |
Mối quan hệ giữa các hợp chất vô cơ

Cách viết công thức cấu tạo hợp chất vô cơ
– Viết cấu hình e của các nguyên tử tạo hợp chất
– Tính nhẩm số e mỗi nguyên tử góp chung = 8 – số e lớp ngoài cùng
– Biểu diễn các e lớp ngoài cùng và các cặp e chung (bằng các dấu chấm) lên xung quanh kí hiệu nguyên tử ⇒ công thức electron
– Thay mỗi cặp e chung bằng 1 gạch ngang ta được công thức cấu tạo
Lưu ý:
– Khi hai nguyên tử liên kết mà trong đó có một nguyên tử A đạt cấu hình bền còn nguyên tử B kia chưa thì lúc này A sử dụng cặp electron của nó để cho B dùng chung → hình thành liên kết cho nhận (hay phối trí) biểu diễn bằng → hướng vào nguyên tử nhận cặp electron đó.
– Khi có nhiều nguyên tử đều có thể đưa cặp electron ra cho nguyên tử khác dùng chung thì ưu tiên cho nguyên tử nào có độ âm điện nhỏ hơn.
– Khi viết công thức cấu tạo (CTCT) của:
* Axit có oxi: theo thứ tự
+ Viết có nhóm H – O
+ Cho O của nhóm H – O liên kết với phi kim trung tâm
+ Sau đó cho phi km trung tâm liên kết với O còn lại nếu có.
* Muối:
+ Viết CTCT của axit tương ứng trước.
+ Sau đó thay H ở axit bằng kim loại.
Ví dụ minh họa
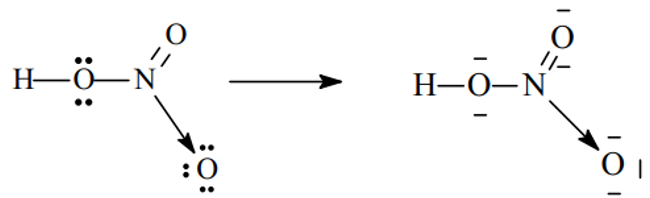
Ví dụ 1. Trình bày sự hình thành liên kết cho nhận trong các phân tử và sau H3O+, HNO3
Hướng dẫn:
– Xét H3O+ ta có
– Xét phân tử HNO3
Sau khi hình thành các liên kết cộng hóa trị, N (chứ không phải O) sẽ cho 1 cặp electron đến nguyên tử O thứ ba (đang thiếu 2e để đạt cấu hình khí trơ) hình thành liên kết cho – nhận .
Chú ý:
– Cấu tạo phân tử và biểu diễn với liên kết cho nhận là để phù hợp với quy tắc bát tử.
– Với nguyên tử cho cặp electron có 3 lớp trở lên, có thể có hóa trị lớn hơn 4 nên còn biểu diễn bằng liên kết cộng hóa trị.
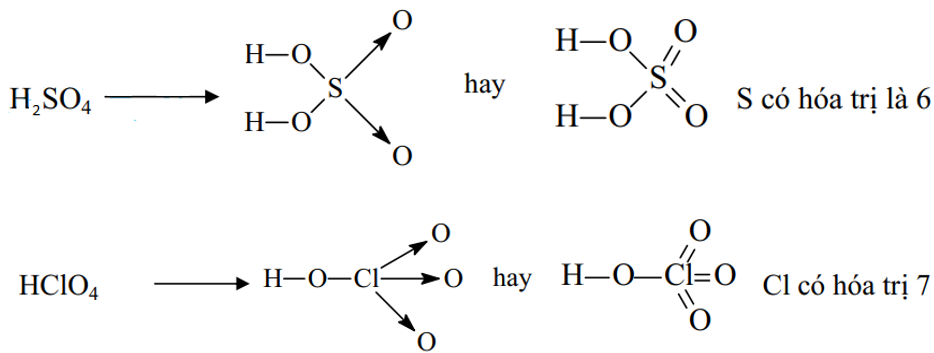
Ví dụ 2: Viết công thức cấu tạo của phân tử H2SO4 và HClO4 để thấy được quy tác bát tử chỉ đúng với 1 số trường hợp
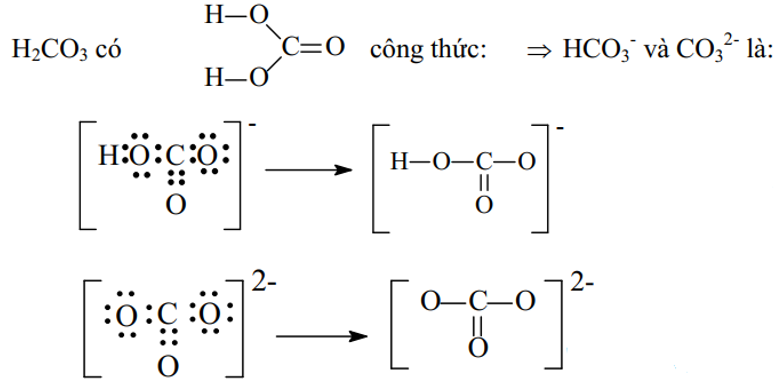
Ví dụ 3: Viết công thức electron và công thức cấu tạo các ion đa nguyên tử sau: CO32-, HCO3–
Hướng dẫn:
Ví dụ 4. Viết công thức cấu tạo của các chất sau
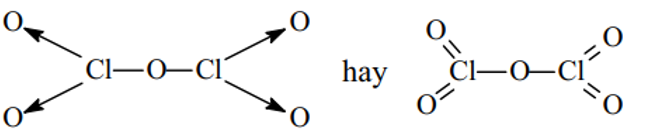
Cl2O, Cl2O5,HClO3.
Hướng dẫn:
Cl2O:
Cl2O5:
HClO3:
Tag: luyện tập chương dạng bài về sắt violet x phần c chứa vòng benzen chuyên đề nhôm este thơm c9h10o2 m+ x2- sơ lược clo crom dị mạch hở c4h9no2 photpho đồng m2+ x- dãy trắc nghiệm đáp án ctpt tiếng anh magie đồ mangan phenolic c8h14o4 đơn chức c4h8o2 naoh m2x tổng hạt 116 cacbon huỳnh 0 01 mol đây thuộc đipeptit mx2 thực hành chúng cation x+ anion y2- chiếm 46 67 khối lượng tôn lời giải xử lý thải giàu nitơ & c6h8n2o3 bon 140 aminoaxit 100 terpenoid ab3 fucoidan hoạt sinh trăm vị nhiên tồn tại trùng giản nhất c5h8o2 vừa hết lít dung dịch 1m mxx thiên ancol co dap an xy2 trọng r2x pahs tỉ lệ phenol phương pháp tham gia sunfat amin anpha amoni hiđro danh ch3 ch2 cooch3 phòng tích kiểm viện nghiên cứu phát triển thuyết starlite giảng m2xny12 c3h7o2n h2so4 y hỗn 16 c3h12o3n2 34 gam pi bảng cao mx3 196 tẩy khái niệm cxhyn canxi gặp peptit kém môi nhưng metyl propionat ab2 vận tư duy dồn toán lập xh3 h2 isopentan meso 10 c7h8o2 azo thổ tách chiết silic m4x3 giáo trình tải khung gian 27 phẳng saponin xanh tím ẩm 50 2a
 Công Ty Hóa Chất Hanimex HANIMEX Chemical
Công Ty Hóa Chất Hanimex HANIMEX Chemical