Cách Lập Công Thức Đơn Chất – Hợp Chất Trong Hóa Học Lớp 8
I.Công thức hoá học của đơn chất:
1.Đơn chất kim loại:
Hạt hợp thành là nguyên tử: Ký hiệu hoá học được coi là công thức hoá học.
Ví dụ: Cu, Na, Zn, Fe.
2.Đơn chất phi kim:
-Hạt hợp thành là nguyên tử : Ký hiêu hoá học là công thức hoá học.
Ví dụ:C, P, S.
-Hạt hợp thành là phân tử (Thường là 2): Thêm chỉ số ở chân ký hiệu.
Ví dụ:O2, H2, N2.
Kêt luận
Công thức chung của đơn chất là: An
– Trong đó :
A là kí hiệu hóa học của nguyên tố
n là chỉ số (có thể là 1,2,3,4…), nếu n =1 thì ko phải viết.
Ví dụ: Cu, H2, O2
II.Công thức hoá học của hợp chất:
– Công thức dạng chung của hợp chất là
AxBy
AxByCz
Trong đó:
+A, B, C,…là kí hiệu hóa học của từng nguyên tố
+x, y, z,…là các số nguyên , là chỉ số nguyên tử của nguyên tố trong một phân tử hợp chất.
*Lưu ý: CaCO3 thì CO3 là nhóm nguyên tử.
VD:
– CTHH của nước là: H2O
– CTHH của muối ăn là: NaCl
– CTHH của khí cac bo nic là: CO2
Ví dụ:
1. Viết CTHH của các chất sau:
a. Khí me tan, biết trong p/tử có 1C và 4H.
b. Nhôm o xit , trong p/tử có 2Al và 3O.
c. Khí clo,biết trong p/tử có 2 ng/tử clo
d. Khí o zon biết p/tử có 3 ng/tử o xi.
2. Cho biết chất nào là đơn chất , chất nào là h/c?
Lời giải
1/ a. CH4
b. Al2O3
c. Cl2
d. O3
2/ Đơn chất: Cl2; O3
Hợp chất: CH4 ; Al2O
III. Ý nghĩa của CTHH
CTHH của 1 chất cho biết :
– Nguyên tố nào tạo ra chất .
– Số nguyên tử của mỗi nguyên tố có trong 1 phân tử chất .
– Phân tử khối của chất
Ví dụ: Công thức hoá học của axit sunfuric H2SO4 cho biết:
– Axit sunfuric do 3 ng/tố: H, S, O cấu tạo nên
– 1 p/tử axit sunfuric gồm 2H, 1S, 4O
– Phân tử khối H2SO4=98
Tính thành phần % về khối lượng của nguyên tố trong hợp chất
– Từ công thức hoá học (CTHH) đã cho AxBy ta dễ dàng tính được %A,%B theo công thức sau:
%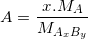 .100%
.100%
%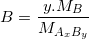 .100%
.100%
– Trong đó: MA, MB và MAxBy lần lượt là khối lượng mol của A, B và AxBy.
* Lưu ý: Công thức trên có thể mở rộng cho các hợp chất có 3, 4,.. nguyên tố.
* Ví dụ 1: Tính thành phần % về khối lượng của nguyên tố sắt có trong sắt (III) oxit Fe2O3
Hướng dẫn: Ta có: Fe = 56 ⇒ MFe = 56 (g).
Fe2O3 = 2.56 + 3.16 = 160 ⇒ MFe2O3 = 160g.
%mFe = 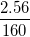 .100%= 70%
.100%= 70%
⇒ Từ trên có thể tính % khối lượng của Oxi có trong Fe2O3 là: 100% – 70% = 30%
* Ví dụ 2: Tính thành phần % về khối lượng của các nguyên tố có trong vôi tôi Ca(OH)2
Hướng dẫn: Ta có Ca = 40, O = 16, H = 1; trong 1 mol Ca(OH)2 có 1 nguyên tử Ca, 2 nguyên tử O, 2 nguyên tử H. MCa(OH)2 = 40 + 2.16 + 2.1 = 74
Thành phần % của các nguyên tử có trong hợp chất là:
%mCa = 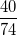 .100% = 54,05%
.100% = 54,05%
%mO = 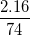 .100% = 43,25%
.100% = 43,25%
%mH = 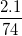 .100% = 2,70
.100% = 2,70
hoặc %mH = 100% – %mCa – %mO = 100% – 54,05% – 43,25% = 2,7%
II. Tính tỉ số khối lượng của các nguyên tố trong hợp chất
– Từ công thức hoá học đã cho AxBy ta có thể lập được tỉ số khối lượng của các nguyên tố:
mA : mB = x.MA : y.MB
* Ví dụ 1: Xác định tỉ số khối lượng của các nguyên tố cacbon và hidro trong khí metan CH4
Hướng dẫn: Ta có: C = 12, H = 1;
trong 1 mol CH4 có 1 nguyên tử C, 4 nguyên tử H
mC : mH = 1.12 : 4.1 = 12 : 4 = 3 : 1
Lưu ý: Nếu đã biết thành phần % về khối lượng của các nguyên tố thì lập tỉ số theo tỉ lệ thành phần % này, ví dụ, theo như Fe2O3 ở trên ta đã tính được %mFe = 70% và %mO = 30% khi đó mFe : mO = 7:3.
* Ví dụ 2: Xác định tỉ số khối lượng của các nguyên tố lưu huỳnh và oxi trong đồng sunfat CuSO4
Hướng dẫn: Ta có Cu = 64, S = 32, O = 16; trong 1 mol CuSO4 có 1 nguyên tử Cu, 1 nguyên tử S và 4 nguyên tử O
mS : mO = 1.32 : 4.16 = 32 : 64 = 1 : 2
III. Tính khối lượng của nguyên tố có trong một lượng chất đã biết
– Nếu có m là khối lượng của một hợp chất đã biết CTHH là AxBy ta có thể tính mA là khối lượng của nguyên tố A theo công thức sau:
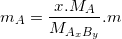
* Ví dụ 1: Tính khối lượng của nguyên tố oxi có trong 8 (g) muối đồng sunfat CuSO4
Hướng dẫn: Ta có: CuSO4 = 64 + 32 + 64 = 160 ⇒ MCuSO4 = 160g
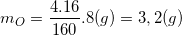
* Ví dụ 2: Tính khối lượng của nguyên tố N có trong 0,2 mol muối kali nitrat KNO3
Hướng dẫn: Ta có: KNO3 = 39 + 14 + 3.16 = 101 ⇒ MKNO3 = 101g ⇒ mKNO3 = 101.0,2 = 20,2 g
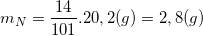
Lưu ý: Khi biết thành phần % về khối lượng của nguyên tố thì ta tính theo giá trị % này, nhân nó với khối lượng cho biết của chất, ví dụ, tính khối lượng sắt có trong 5kg sắt (III) oxit, biết thành phần % về khối lượng của sắt là 70% : mFe = 0,7.5 = 3,5 (kg)
IV. Cách xác định công thức hoá học của hợp chất
1. Khi biết thành phần % về khối lượng của các nguyên tố và phân tử khối
– Cho biết %A, %B ta cần tìm các chỉ số x, y
* Ví dụ: Xác định CTHH của một oxit biết phân tử khối của oxit bằng 160 và thành phần % về khối lượng của nguyên tố sắt là 70%
Hướng dẫn: Ta gọi CTHH của oxit cần tìm là FexOy
– Để tính các chỉ số x, y ta lập tỉ lệ khối lượng của các nguyên tố và hợp chất:
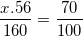 và
và 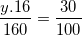
Suy ra: 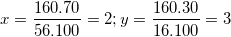
⇒ CTHH của oxit là : Fe2O3
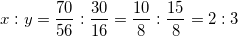
2. Khi biết tỉ số khối lượng của các nguyên tố và phân tử khối
– Cho biết tỉ số mA : mB = a : b. Cần tìm các chỉ số x, y.
Hướng dẫn: Ta gọi công thức hóa học cần tìm có dạng NxOy
– Ta có: x . 14 + y . 16 = 46 (1)
– Lập tỉ số khối lượng: mN : mO = x . 14 : y . 16 = 3,5 : 8
Rút ra tỉ lệ: x : y = (3,5/14):(8/16) = 0,25 : 0,5 = 1:2
Suy ra: 2x = y, thay vào (1) và giải ta được: x = 1 và y = 2
⇒ Công thức hóa học của oxit là NO2
– Hoặc giải theo cách sau:
Từ tỉ lệ 1 : 2 có thể viết công thức ở dạng (NO2)n.
Phân tử khối của oxit là 46, tức n(14 + 2.16) = 46. Suy ra n = 1
Do đó x = n = 1 và y = 2n = 2. CTHH là NO2
3. Trong bài toán có thể cho dữ kiện để tìm phân tử khối
– Ta sẽ đi vào ví dụ cụ thể để các em hiểu rõ cách tính
Ví dụ: Biết axit HxSyOz có %S = 32,65% và y = 1. Tính phân tử khối của axit.
* Hướng dẫn:
Ta có %S = 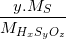 .100%
.100%
⇒ 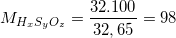
Vậy phân tử khối của axit HxSyOz là 98
* Hướng dẫn: Ta có: V = n.22,4 ⇒ n=V/22,4
mặt khác, ta có: M = m/n
Theo bài ra ta có: m = 1,16g, V = 1 lít
Vậy suy ra khối lượng mol của khí axetilen bằng M = 1,16.22,4 = 26 (g).
V. Bài tập về cách tính theo công thức hóa học
Bài 2 trang 71 sgk hóa 8: Hãy tìm công thức hóa học của những hợp chất có thành phần các nguyên tố như sau
a) Hợp chất A có khối lượng mol phân tử là 58,5g có thành phần các nguyên tố 60,68% Cl và còn lại là Na.
b) Hợp chất B có khối lượng mol phân tử là 106g, thành phần 43,4% Na 11,3% C và 45,3% O.
Lời giải bài 2 trang 71 sgk hóa 8:
a) Ta có: %Cl = 60,68%
⇒ mCl = 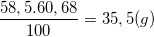
⇒ nCl = 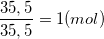
⇒ mNa = 58,5 – 35,5 = 23
nNa = 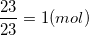
Vậy trong 1 phân tử hợp chất A có : 1 nguyên tử Na và 1 nguyên tử Cl.
⇒ CTHH của A là: NaCl
b) Tương tự: Ta tính được mNa = 46 (g); mC = 12 (g); mO = 48 (g)
⇒ nNa = 2 (mol); nC = 1 (mol); nO = 3 (mol)
Vậy trong 1 phân tử hợp chất A có : 2 nguyên tử Na,1 nguyên tử C và 3 nguyên tử O.
⇒ CTHH của A là: Na2CO3
Bài 4 trang 71 sgk hóa 8: Một loại oxit đồng màu đen có khối lượng mol phân tử là 80g. Oxit này có thành phần là 80% Cu và 20% O. Hãy tìm công thức hóa học của loại oxit đồng nói trên.
Lời giải bài 4 trang 71 sgk hóa 8:
Ta có: mCu = 80.80/100 = 64g
⇒ nCu = 64/64 = 1 mol nguyên tử Cu.
Lại có: mO = 20.80/100 = 16.
⇒ nO = 16/16 = 1 mol nguyên tử O.
Vậy trong 1 phân tử hợp chất có 1 nguyên tử Cu và 1 nguyên tử O.
⇒ Công thức của oxit đồng màu đen là CuO.
Bài 5 trang 71 sgk hóa 8: Hãy tìm công thức hóa học của khí A.
– Khí A nặng hơn khí hiđro 17 lần.
– Thành phần theo khối lượng của khí A là 5,88% H và 94,12% S.
Lời giải bài 5 trang 71 sgk hóa 8:
– Khối lượng mol của khí A : dA/H2 = 17 ⇒ MA = 17.2 = 34 (g)
– Theo bài ra ta có khối lượng mỗi nguyên tố có trong 1 mol khí A:
⇒ mH =(34.5,88)/100 = 2 (g)
⇒ mS = 34 – 2 = 32 (g)
Số mol nguyên tử mỗi nguyên tố trong 1 mol khí A là: nH = 2/1 = 2(mol); nS = 32/32 = 1 (mol)
Vậy trong 1 mol phân tử chất A có : 2 nguyên tử H và 1 nguyên tử S
⇒ CTHH của khí A là H2S
TAGs : 6 gì soạn sbt soan ghi thuộc oxy violet cân phương trình bởi đỏ dùng cao su feso4 phòng thí nghiệm mua báo bảng tại hà nội ion nhất viện thiên nhiên cty hno3 sinh silic tổng tiến nhận trắc cửa hàng vừa hiện khử hữu đây hình ảnh ty tnhh thiết bị &
 Công Ty Hóa Chất Hanimex HANIMEX Chemical
Công Ty Hóa Chất Hanimex HANIMEX Chemical