Tìm Hiểu Về Tính Chất Hóa Học Của Nito Lỏng Nito Oxit
Nito lỏng
Nitơ lỏng là nitơ trong một trạng thái lỏng ở nhiệt độ rất thấp. Nó được sản xuất công nghiệp bằng cách chưng cất phân đoạn không khí lỏng. Nitơ lỏng là một chất lỏng trong suốt, không màu, trọng lượng riêng 0,807 g/ml ở điểm sôi của nó và một hằng số điện môi 1.4. Nitơ lỏng thường được gọi bằng LN2, viết tắt hoặc “LIN” hoặc “LN “và có số UN 1977.
Ở áp suất khí quyển, nitơ lỏng sôi ở nhiệt độ 77 K (-196 °C, -321 °F) và là một chất lỏng đông lạnh có thể gây đóng băng nhanh chóng khi tiếp xúc với mô sống, có thể dẫn đến bị tê cóng do vậy phải luôn tuân thủ an toàn khi làm việc với chất này. Khi được cách nhiệt thích hợp với nhiệt độ xung quanh, nitơ lỏng có thể được lưu trữ và vận chuyển, ví dụ trong bình chân không. Ở đây, nhiệt độ rất thấp được tổ duy trì xuyên tại 77 K bằng cách làm chậm sôi của chất lỏng, dẫn đến sự chuyển hóa của khí nitơ. Tùy thuộc vào kích thước và thiết kế, thời gian lưu trữ trong bình chân không bình từ vài giờ đến vài tuần.
Nitơ lỏng có thể dễ dàng được chuyển đổi thành các chất rắn bằng cách đặt nó trong một khoang bơm chân không bằng một máy bơm chân không quay. Nitơ lỏng đóng băng ở 63 K (-210 °C, -346 °F). Dù có vai trò quan trọng trong việc làm lạnh, hiệu quả của nitơ lỏng là chất làm mát bị hạn chế bởi thực tế là nó sôi ngay lập tức khi tiếp xúc với một đối tượng ấm lên, bao quanh các đối tượng trong cách điện khí nitơ.
Hiệu ứng này, được gọi là hiệu ứng Leidenfrost, áp dụng cho bất kỳ chất lỏng trong tiếp xúc với một đối tượng đáng kể nóng hơn điểm sôi của nó. làm mát nhanh hơn có thể thu được bằng cách chìm một đối tượng vào một bằng cháo của nitơ lỏng và rắn hơn vào nitơ lỏng một mình.

Tính chất hoá học của Nitơ
– Các mức oxi hóa mà Nitơ (N) có thể có là: -3, 0, +1, +2, +3, +4, +5.
– Vì phân tử chứa liên kết ba rất bền vững nên ở điều kiện thường, nitơ là một chất ít hoạt động chỉ tham gia phản ứng ở nhiệt độ cao. Nitơ vừa là chất khử vừa là chất oxi hóa.
1. Nitơ là chất oxi hóa
a) Nitơ tác dụng với kim loại → Muối Nitrua.
– PTPƯ: N2 + Kim loại → Muối Nitrua
+ Nhiệt độ thường chỉ tác dụng với Li:
6Li + N2 → 2Li3N
+ Nhiệt độ cao phản ứng với một số kim loại như Mg, Ca và Al,…
2Al + N2 → 2AlN
3Ca + N2 → Ca3N2
b) Nitơ tác dụng với H2 → Amoniac
N2 + 3H2 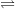 2NH3
2NH3
– Phản ứng này xảy ra trong điều kiện nhiệt độ > 4000C; áp suất p và xúc tác Fe.
2. Nitơ là chất khử (N2 + O2)
– Phản ứng của Nitơ với Oxi xảy ra ở nhiệt độ 30000C hoặc trong lò hồ quang điện
N2 + O2 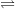 2NO
2NO
– Khí NO không màu hoá nâu trong không khí do phản ứng:
2NO không màu + O2 → 2NO2 (màu nâu đỏ)
3. Điều chế nitơ
– Trong phòng thí nghiệm: nhiệt phân muối amoni nitrit
NH4NO2 ![small xrightarrow[]{t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2019_03/1553767618me3b447lcb.gif) N2 + 2H2O
N2 + 2H2O
NH4Cl + NaNO2 ![small xrightarrow[]{t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2019_03/1553767618me3b447lcb.gif) N2 + NaCl + 2H2O
N2 + NaCl + 2H2O
– Trong công nghiệp: chưng cất phân đoạn không khí lỏng, dùng màng lọc rây phân tử.
4. Cách nhận biết Nitơ
– Trong các bài toán nhận biết, N2 thường được để lại để nhận biết sau cùng.
5. Ứng dụng của Nitơ
– Trong tự nhiên, nitơ tồn tại ở dạng tự do và trong hợp chất:
+ Dạng tự do: Nitơ chiếm 80% thể tích không khí.
+ Dạng hợp chất: có nhiều ở dạng NaNO3 (diêm tiêu natri), trong thành phần protein, axit nucleic…
– Nitơ được ứng dụng phần lớn được dùng để tổng hợp amoniac từ đó sản xuất ra các loại phân đạm, axit nitric,..
– Nitơ còn được dùng làm môi trường trơ cho các ngành công nghiệp luyện kim; nitơ lỏng được dùng để bảo quản máu và các các mẫu sinh học khác,…
 Công Ty Hóa Chất Hanimex HANIMEX Chemical
Công Ty Hóa Chất Hanimex HANIMEX Chemical