Bài Tập Có Lời Giải Hóa Học 9 Tính Chất Của Muối Và Bazo
Muối và Bazo là những kiến thức cơ bản về hóa học đang được dạy ở chương trình hóa phổ thông , đặc biệt là các bạn đang học lớp 9 . Nhằm mục địch trang bị kiến thức cũng như cung cấp thêm nguồn tài liệu trợ giúp để việc học hóa được thuận lợi hơn hôm nay công ty hóa chất Hanimex xin được chia sẻ đến bạn đọc một số bài tập cơ bản về muối và bazo
I/ Muối và các bài tập về muối
Muối có 5 tính chất hóa học đặc trưng:
- Tác dụng với kim loại
- Tác dụng với bazo
- Tác dụng với axit
- Tác dụng với muối
- Bị nhiệt phân
Bài tập về Muối và phản ứng trao đổi
Bài 1 trang 33 SGK hóa 9: Hãy dẫn ra một dung dịch muối khi tác dụng với một dung dịch chất khác thì tạo ra:
a) Chất khí.
b) Chất kết tủa.
Viết các phương trình hóa học.
* Lời giải bài 1 trang 33 SGK hóa 9:
a) Tạo ra chất khí, ví dụ muối cacbonat (CaCO3, Na2CO3, NaHCO3) hoặc dung dịch muối sunfit (Na2SO3) tác dụng với axit (HCl, H2SO4 loãng):
CaCO3 + H2SO4 → CaSO4 + CO2↑ + H2O
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
Na2SO3 + H2SO4 → Na2SO4 + SO2↑ + H2O
b) Tạo chất kết tủa, ví dụ dung dịch muối (BaCl2, Ba(NO3)2,…) tác dụng với dung dịch H2SO4 tạo ra kết tủa trắng BaSO4.
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Ba(NO3)2 + H2SO4 → BaSO4↓ + HNO3
– Hoặc những dung dịch muối bari tác dụng với dung dịch muối cacbonat (Na2CO3, K2CO3) tạo ra BaCO3 kết tủa trắng.
Ba(NO3)2 + Na2CO3 → BaCO3↓ + 2NaNO3.
Bài 2 trang 33 SGK hóa 9: Có 3 lọ không nhãn, mỗi lọ đựng dung dịch muối sau: CuSO4, AgNO3, NaCl. Hãy dùng những dung dịch có sẵn trong phòng thí nghiệm để nhận biết chất đựng trong mỗi lọ. Viết các phương trình hóa học.
* Lời giải bài 2 trang 33 SGK hóa 9:
– Trích mẫu thử và đánh số thứ tự:
– Dùng dd NaCl có sẵn trong phòng thí nghiệm lần lượt cho vào từng mẫu thử trên:
+ Có kết tủa trắng xuất hiện đó là sản phẩm của AgNO3.
PTHH: NaCl + AgNO3 → AgCl↓ + NaNO3
+ Không có hiện tượng gì là CuSO4 và NaCl
– Dùng dung dịch NaOH có trong phòng thí nghiệm cho vào 2 mẫu còn lại:
+ Mẫu nào có kết tủa đó là sản phẩm của CuSO4.
PTHH: CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4.
+ Còn lại là NaCl.
Bài 3 trang 33 SGK hóa 9: Có những dung dịch muối sau: Mg(NO3)2, CuCl2. Hãy cho biết muối nào có thể tác dụng với:
a) Dung dịch NaOH.
b) Dung dịch HCl.
c) Dung dịch AgNO3.
Nếu có phản ứng, hãy viết các phương trình hóa học.
* Lời giải bài 3 trang 33 SGK hóa 9:
a) Tác dụng với dung dịch NaOH là dung dịch các muối Mg(NO3)2 và CuCl2 vì sinh ra
Mg(OH)2 kết tủa, Cu(OH)2 kết tủa.
Mg(NO3)2 + 2NaOH → Mg(OH)2 ↓ + 2NaNO3
CuCl2 + 2NaOH → Cu(OH)2 ↓ + 2NaCl
b) Không muối nào tác dụng với dung dịch HCl.
c) Tác dụng với dung dịch AgNO3 là dung dịch muối CuCl2 tạo AgCl kết tủa trắng.
CuCl2 + 2AgNO3 → 2AgCl ↓ + Cu(NO3)2.
Bài 4 trang 33 SGK hóa 9: Cho những dung dịch muối sau đây phản ứng với nhau từng đôi một, hãy ghi dấu (x) nếu có phản ứng, dấu (o) nếu không:
| Na2CO3 | KCl | Na2SO4 | NaNO3 | |
| Pb(NO3)2 | ||||
| BaCl2 |
Hãy viết phương trình hóa học ở ô có dấu (x).
* Lời giải bài 4 trang 33 SGK hóa 9:
| Na2CO3 | KCl | Na2SO4 | NaNO3 | |
| Pb(NO3)2 | x | x | x | o |
| BaCl2 | x | o | x | o |
– Phương trình hóa học của các phản ứng:
Pb(NO3)2 + Na2CO3 → PbCO3↓ + 2NaNO3
Pb(NO3)2 + 2KCl → PbCl2↓ + 2KNO3
Pb(NO3)2 + Na2SO4 → PbSO4↓ + 2NaNO3
BaCl2 + Na2CO3 → BaCO3↓ + 2NaCl
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl.
Bài 5 trang 33 SGK hóa 9: Ngâm một đinh sắt sạch trong dung dịch đồng (II) sunfat. Câu trả lời nào sau đây là đúng nhất cho hiện tượng quan sát được?
a) Không có hiện tượng nào xảy ra.
b) Kim loại đồng màu đỏ bám ngoài đinh sắt, đinh sắt không có sự thay đổi.
c) Một phần đinh sắt bị hòa tan, kim loại đồng bám ngoài đinh sắt và màu xanh của dung dịch ban đầu nhạt dần.
II/ Một số bài tập cơ bản về Bazo
Tính chất hóa học
1) Tác dụng với chất chỉ thị màu.
– Dung dịch bazơ làm quỳ tím đổi thành màu xanh.
– Dung dịch bazơ làm phenolphthalein không màu đổi sang màu đỏ.
2) Dung dịch bazơ tác dụng với oxit axit tạo thành muối và nước.
Ví dụ: 2NaOH + SO2 → Na2SO3 + H2O
3Ca(OH)2 + P2O5 → Ca3(PO4)2↓ + 3H2O
3) Bazơ (tan và không tan) tác dụng với axit tạo thành muối và nước.
Ví dụ: KOH + HCl → KCl + H2O
Cu(OH)2 + 2HNO3 → Cu(NO3)2 + H2O
4) Dung dịch bazơ tác dụng với nhiều dung dịch muối tạo thành muối mới và bazơ mới.
Ví dụ: 2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
Lưu ý: Điều kiện để có phản ứng xảy ra: Muối tạo thành phải là muối không tan hoặc bazơ tạo thành phải là bazơ không tan.
5) Bazơ không tan bị nhiệt phân hủy thành oxit và nước.
Ví dụ: Cu(OH)2 CuO + H2O
2Fe(OH)3 Fe2O3 + 3H2O
Bài 2 trang 25 SGK Hóa 9: Có những bazơ sau: Cu(OH)2, NaOH, Ba(OH)2. Hãy cho biết những bazơ nào:
a) Tác dụng được với dung dịch HCl?
b) Bị nhiệt phân hủy?
c) Tác dụng được với CO2?
d) Đổi màu quỳ tím thành xanh?
Viết các phương trình hóa học.
* Lời giải bài 2 trang 25 SGK Hóa 9:
a) Tất cả các bazơ đã cho đều phản ứng với dung dịch HCl.
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
NaOH + HCl → NaCl + H2O
Ba(OH)2 + 2HCl → BaCl2 + H2O
b) Bị phân hủy ở nhiệt độ cao là các bazo không tan : Cu(OH)2
Cu(OH)2 CuO + H2O
c) Tác dụng với CO2 là các dung dịch bazo (kiểm) NaOH, Ba(OH)2
CO2 + NaOH → NaHCO3
CO2 + 2NaOH → Na2CO3 + H2O
CO2 + Ba(OH)2 → BaCO3 ↓ + H2O
2CO2 + Ba(OH)2 → Ba(HCO3)2
d) Đổi màu quỳ tím thành xanh: các kiềm NaOH, Ba(OH)2.
Bài 3 trang 25 SGK Hóa 9: Từ những chất có sẵn là: Na2O, CaO, H2O. Hãy viết các phương trình hóa học điều chế các dung dịch bazơ.
* Lời giải bài 3 trang 25 SGK Hóa 9:
– Điều chế các dung dịch bazơ (kiềm):
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2.
Bài 4 trang 25 SGK Hóa 9: Có 4 lọ không nhãn, mỗi lọ đựng một dung dịch không màu sau: NaCl, Ba(OH)2 và Na2SO4. Chỉ được dùng quỳ tím, làm thế nào nhận biết dung dịch đựng trong mỗi lọ bằng phương pháp hóa học? Viết các phương trình hóa học.
* Lời giải bài 4 trang 25 SGK Hóa 9:
– Trích mẫu thử và đánh số thứ tự:
– Cho quỳ tím vào từng mẫu thử của các dung dịch trên, kết quả chia làm hai nhóm:
• Nhóm I: Quỳ tím đổi màu thành xanh: Ba(OH)2 và NaOH.
• Nhóm II: Quỳ tím không đổi màu: NaCl và Na2SO4.
– Phân biệt các chất trong các nhóm: Lấy từng chất của nhóm I đổ vào từng chất của nhóm II, ta nhận thấy có hai chất đổ vào nhau cho kết tủa trắng là Ba(OH)2 và Na2SO4 hai chất còn lại không phản ứng là NaOH và NaCl.
– PTPƯ: Ba(OH)2 + Na2SO4 → BaSO4 ↓ trắng + 2NaOH.
Bài 5 trang 25 SGK Hóa 9: Cho 15,5g natri oxit Na2O tác dụng với nước, thu được 0,5 lít dung dịch bazơ.
a) Viết phương trình hóa học và tính nồng độ mol của dung dịch bazơ thu được.
b) Tính thể tích dung dịch H2SO4 20%, có khối lượng riêng 1,4 g/ml cần dùng để trung hòa dung dịch bazơ nói trên.
* Lời giải bài 5 trang 25 SGK Hóa 9:
– Theo bài ra, ta có: nNa2O = m/M = 15,5/62 = 0,25 (mol).
a) Phương trình phản ứng:
Na2O + H2O → 2NaOH
– Theo PTPƯ: nNaOH = 2.nNa2O = 2.0,25 = 0,5 (mol).
– Nồng độ mol của dd bazo là: 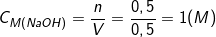
b) Phương trình phản ứng:
2NaOH + H2SO4 → Na2SO4 + 2H2O
– Theo PTPƯ: nH2SO4 = (1/2).nNaOH = (1/2).0,5 = 0,25 (mol).
⇒ mH2SO4 = n.M = 0,25.98 = 24,5 (g).
– Từ công thức tính nồng độ phần trăm của dd:
C%=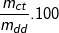 % ⇒ mdd (H2SO4) = mct/C% = (24,5/20%) = (24,5.100)/20 = 122,5 (g).
% ⇒ mdd (H2SO4) = mct/C% = (24,5/20%) = (24,5.100)/20 = 122,5 (g).
– Ta lại có, khối lượng riêng: 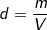
Trên đây là một số bài tập về muối và bazo mà hóa chất Hanimex gửi đến bạn đọc có thêm thông tin tham khảo ôn tập. Hi vọng với chia sẻ này phần nào giúp các bạn học sinh nắm chắc hơn kiến thức về môn hóa học . Hóa chất Hanimex chúc các bạn học tập tốt .
TAGs : béo dư oxi cách phi hidro đếm 8 đơn nguyên tố trắc biến lý thuyết hợp violet lập hiđrô 12 luyện este hết 11 silic chuyển vật năng thực 7 soạn giảng đáp án sbt nitrat sơ đồ tư duy photphat
 Công Ty Hóa Chất Hanimex HANIMEX Chemical
Công Ty Hóa Chất Hanimex HANIMEX Chemical